domingo, 1 de septiembre de 2019
SEMANA #27
Clasificación de las reacciones químicas orgánicas
Reacciones polares:
Rx de sustitución o desplazamientoRx de adición
Rx de eliminación
Rx de regrupamiento
Rx de oxidació y reducción
Rx de acido-base
Reacciones no polares
Rx de sustitución o desplazamiento
Rx de adición
Rx de eliminación
Rx de reagrupamiento
Rx sustitución no polar (R°)
Rx general HC + X2 →u.v HCX + HX
sust. react. ppl. subprod.
Meacanismo:
Etapa: Iniciación Se genera el rdical libre
X2 →u.v X°+ X°
II Etapa: propagación
HC + X → HC° + HX
HC + X2 → HCX + X°
III Terminación: Se unen radicaes libres
HC° + X°→ HCX
X° + X°→ X2
HC°+ °CH→HCCH
RX general CH4 + Cl2→u.v H3C-Cl + HCl
I et. iniciación Cl2 →u.v Cl° + Cl°
II et. propagación CH4 + °Cl→°CH3 + HCl
°CH3 + Cl2 → H3CCl + °Cl
III terminación Cl° + Cl°→ Cl2
°CH3 + °CH3→ H3C-CH3
°CH3 + Cl →CH3Cl
SEMANA #25
Reacciones Organicas
Las reacciones orgánicas se dividen en 2 grupos: reacciones polares y no polares, esto depende del tipo de reactivos que intervienen en las reacciones.
Rx polares: emplean reactivos llamados electrofilos y nucleofilos.
Rx no polares: emplean ractivos llamados radicales libres.
Los reactivos organicos se generan mediante 2 procesos:
A|°°B → A+ electrofilo B- nucleofilo
A°°|B→ A- + B+
Los electrofilos se obtiene por un rompimiento heterolitico en el cual el electrofilo queda con deficiencia de electrones y es positivo.
Nucleofilo: Es una especie que tiene exceso de electrones y que se forma a partir de un rompimiento heterolitico °°B-
Ej: HO|°°H→ H+ electrofilo °°OH- nucleofilo
Radicales libres (R):
Son átomos o moléculas que tienen un electrón desapareado, estas especies son muy inestables químicamente y por ello son muy reactivas. Los radicales libres se obtiene por rompimiento hemolítico.
A°|°B→A° + B°
Las partes de una rx orgánicas son:
Sustrato: el grupo funcional que será atacado por los reactivos.
Producto principal: lo que esperamos se forme en la rx química
Subproductos: son las sustancias no esperadas, que se forman
Representación graica de una reacción orgánica

Rx de oxidación de los H-C
La combustion es la rx más importante de los H-C y dependiendo de la cantidad de oxigeno disponible se presentan 3 tipos de rx, completa, parcial, incompleta.
C7H16 + 11O2→ 7 CO2 + 8H2O + E COMPLETA
C7H16 + 15/2O2→ 7CO + 8H2O + E PARCIAL
C7H16 + 4O2→ 7C + 8H2O + E INCOMPLETA
SEMANA #24
Isomeros Conformacionales
Se forman por la rotación o la flexión en los enlaces para representar los isomeros conformacionales las proyecciones de Newman teniendo en cuentas lo siguiente:

Se forman por la rotación o la flexión en los enlaces para representar los isomeros conformacionales las proyecciones de Newman teniendo en cuentas lo siguiente:
- Se escoge 2 C unidos por enlace sencillo (-) y se llevan a 3 sustituyentes los demás C.
- Se escoge el C que queda fijo y el que rotará
- Se rota en el sentido de las manecillas del relij 60° para obtener 6 isomeros conformacionales
- Los isomeros conformacionales se clasificaran en forma alternada, eclipsada, sin, anti.
Isomeros conformacionales en anillos
Se presentan por la flexión de los enlaces


SEMANA #23
Isomería óptica (esteroisomería)
Un isomero óptico tiene la propiedad de hacer girar el plano de la luz polarizada, hacia la derecha o hacia la izquierdaPara que una sustancia presente actividad óptica debe ser asimétrica, es decir, no debe presentar simetría bilateral, radial, centro o plano de simetría. Para que una sustancia sea asimétrica debe poseer por lo menos un carbono quiral, 1C quiral es aquel que contiene 4 sustituyentes diferentes.

Si la sustancia presenta actividad óptica hacia la derecha es DESTROGIRA y si presenta hacia la izquierda es LEVOGIRA.
El número de isomeros que presenta una sustancia es dado por la formula 2n, n=#C quirales.
Para representar los isomeros ópticos se emplean as proyecciones de Fischer siguiendo los pasos:
- la molécula se debe escribir verticalmente, colocando en la parte superior el carbono mas oxidado
- en la estructura solo deben aparecer los carbonos quirales y se colocan en la intersección de la linea vertical hacia la horizontal.
SEMANA #22
Isomeria configuracional geometric (sis-trans)
Se presenta cuando un enlace doble (=) C-C y los sustituyentes de cada C adyacente al doble enlace son diferentes a≠b, pero entre estos debe haber un sustituyente en común.


Se presenta cuando un enlace doble (=) C-C y los sustituyentes de cada C adyacente al doble enlace son diferentes a≠b, pero entre estos debe haber un sustituyente en común.

SEMANA #21
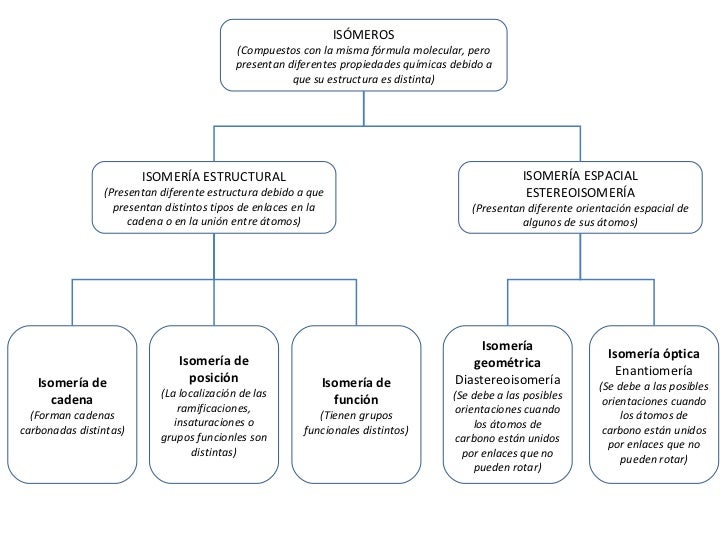
Isomería
¿Qué son los isomeros?Son compuestos que tienen la misma formula molecular, pero difieren en la formula estructural.
I. E. Cadena: Son isomeros que presentan la misma formula molecular, pero diferente formula estructural.
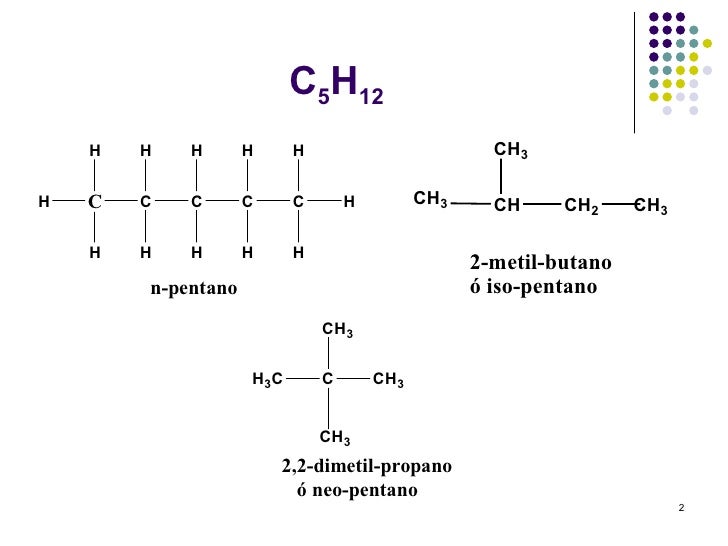
I. E. Función: Son aquellos que tiene la misma formula molecular, igual formula estructural, pero difieren en la función.

I. E. Posición: Son aquellos con igual formula molecular, estructural y grupo funcional, pero difieren en su ubicación.

Suscribirse a:
Comentarios (Atom)